2023年1月2日
2023年1月2日,传奇生物(NASDAQ:LEGN)在中国南京正式宣布,公司首款自主研发的细胞治疗产品西达基奥仑赛注射液(Ciltacabtagene Autoleucel,研究代码LCAR-B38M细胞制剂)新药上市申请(NDA)已获得国家药品监督管理局(NMPA)正式受理。
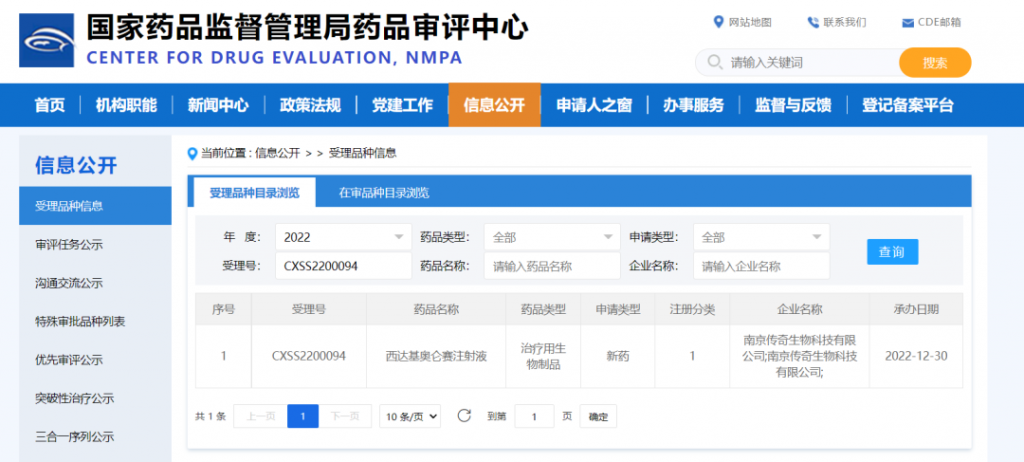
西达基奥仑赛注射液是一种靶向B细胞成熟抗原(BCMA)经嵌合抗原受体基因修饰的自体T细胞产品 (CAR-T细胞),以一次性输注给药。西达基奥仑赛于2018年3月获得国家药品监督管理局首个CAR-T细胞产品临床试验申请(IND)批件,并于2020年8月成为首个纳入中国突破性治疗药物程序的品种。
此次递交是基于在中国开展的确证性临床研究CARTIFAN-1(NCT03758417/CTR20181007)结果,证实了西达基奥仑赛为复发或难治性多发性骨髓瘤患者带来了临床获益。该研究评估了西达基奥仑赛在既往接受过至少3线治疗包括一种蛋白酶体抑制剂(PI)和一种免疫调节剂(IMiD)后复发或难治性多发性骨髓瘤(R/R MM)成人患者中的有效性及安全性。
中国血液病学家和分子遗传学家、中国工程院院士、CARTIFAN-1临床试验主要研究者陈赛娟表示:“多发性骨髓瘤是中国第二大常见的恶性血液肿瘤,高发于中老年人群。据统计,2020年中国多发性骨髓瘤年龄标准化发病率约为1.15/10万人1。随着我国进入老龄化社会,发病率已明显上升,且发病年龄趋于年轻化。尽管近年来患者的生存期已得到显著改善,但很多患者确诊时已是晚期,多数在初始治疗后会复发,且预后较差,该疾病目前仍不可治愈,存在巨大未被满足的临床需求,他们亟需一种更为有效的治疗手段。根据在我国开展的CARTIFAN-1确证性临床试验数据显示,西达基奥仑赛在复发或难治性多发性骨髓瘤患者中显示了持久且深度的获益。我们期待这款CAR-T细胞治疗新药尽早获批,惠及更多患者。”
传奇生物首席执行官黄颖博士表示:“满足临床需求,服务于包括中国患者在内的全球患者一直是传奇生物创新研发的初衷。目前,西达基奥仑赛已在美国、欧洲和日本获批上市。作为诞生于中国的原创新药,此次西达基奥仑赛的上市申请获得国家药监局的正式受理具有特殊的重要意义。我们期待这款疗效显著的产品能在中国早日获批上市,为中国多发性骨髓瘤患者提供新的治疗选择,带来更多治愈的希望。”
关于西达基奥仑赛(Ciltacabtagene Autoleucel)
西达基奥仑赛是一种靶向B细胞成熟抗原 (BCMA) 的嵌合抗原受体 T 细胞 (CAR-T) 产品,使用嵌合抗原受体 (CAR) 的转基因对患者自身的T细胞进行修饰,以识别和消除表达BCMA的细胞。BCMA主要表达于恶性多发性骨髓瘤B细胞、晚期B细胞和浆细胞的表面。西达基奥仑赛的CAR蛋白具有两种BCMA靶向单域抗体,对表达BCMA的细胞具有高亲和力,在与BCMA表达细胞结合后,CAR可促进T细胞活化、扩增,继而清除靶细胞。
2017年12月,杨森与传奇生物签订了全球独家许可和合作协议,以研发和商业化西达基奥仑赛。2020年8月,西达基奥仑赛获得中国首个“突破性治疗药物”资格认证,2019年4月获得了欧盟委员会的优先药物 (PRIME) 指定,2019年12月被美国FDA授予突破性疗法认定。美国FDA 、欧洲EMA和日本PMDA分别于2019年2月、2020年2月和2020年6月授予西达基奥仑赛孤儿药资格认定。2022年2月,西达基奥仑赛获得美国食品药品监督管理局(FDA)批准,商品名CARVYKTI®,5月获得欧盟委员会 (EC) 附条件上市许可,9月获得日本厚生劳动省(MHLW)批准上市,用于治疗成人复发或难治性多发性骨髓瘤。
关于CARTIFAN-1
CARTIFAN-1 (NCT03758417) 是一项2期开放、确证性试验,用于评估西达基奥仑赛治疗中国复发或难治性多发性骨髓瘤(R/R MM)患者的疗效和安全性,这些患者既往至少接受过3线治疗,包括蛋白酶体抑制剂和免疫调节剂,主要研究终点为总缓解率。
关于多发性骨髓瘤
多发性骨髓瘤 (Multiple Myeloma, MM) 被认为是不可治愈的血液肿瘤,是由于骨髓中的浆细胞过度增殖导致的恶性疾病。根据世界卫生组织最新数据,2020年中国有超过21000例新病例和近16200例由于多发性骨髓瘤导致的死亡病例2。虽然有些多发性骨髓瘤患者无明显症状,但大多数患者是由于出现症状而被确诊,这些症状可能包括骨病、低血细胞计数异常、血钙升高、肾脏问题或感染等。虽然经过治疗可能会有一些缓解,但不幸的是,患者很可能会复发。使用标准疗法(包括蛋白酶抑制剂、免疫调节剂和抗CD38单克隆抗体)治疗后复发的患者会面临预后不佳,治疗手段受限的问题。
关于传奇生物
传奇生物(NASDAQ:LEGN)成立于2014年,是一家集肿瘤免疫细胞疗法研发、临床、生产及商业化开发于一体的跨国生物制药公司,位列全球免疫细胞疗法领域第一方阵,全球员工总数已逾1000人。目前通过与杨森的合作,首款产品CARVYKTI®已于2022年获得美国食品药品监督管理局(FDA)、日本厚生劳动省(MHLW)批准上市,并获得欧盟委员会(EC)附条件上市许可,有望解决多发性骨髓瘤治疗的世界级难题。此外,公司还有多款在研细胞疗法,用于血液瘤、实体瘤及其它疑难疾病的治疗。
公司先后入选江苏省战略性新兴产业发展专项资金项目、“江苏省精准细胞免疫治疗工程技术研究中心”、“江苏省研究生工作站”、“江苏省隐形小巨人企业”、“南京市工程研究中心”,“南京市高端研发机构”、“南京市博士后创新实践基地”、“南京市独角兽企业”、“中国独角兽企业”,荣获“江苏省科技进步奖”、“中国生物医药产业链创新风云榜鲲鹏奖”、“中国医药创新企业100强”、“南京市引才用才示范企业金梧桐奖”、“《麻省科技评论》50家聪明公司”、“最具影响力创新疗法企业TOP20”等荣誉。更多信息请访问:www.legendbiotech.cn
参考文献:
[1]Wang S, Xu L, Feng J, Liu Y, Liu L, Wang J, Liu J, Huang X, Gao P, Lu J and Zhan S (2020) Prevalence and Incidence of Multiple Myeloma in Urban Area in China: A National Population-Based Analysis. Front. Oncol. 9:1513. doi: 10.3389/fonc.2019.01513https://www.frontiersin.org/articles/10.3389/fonc.2019.01513/full
[2] Globocan 2020 World Fact Sheet: China.https://gco.iarc.fr/today/data/factsheets/populations/160-china-fact-sheets.pdf. Accessed June 2021.
欧盟委员会批准 CARVYKTI®用于复发和难治性多发性骨髓瘤患者的二线�..
2024年4月23日
传奇生物CARVYKTI®成为首个且唯一获FDA批准用于多发性骨髓瘤二线治�..
2024年4月5日
传奇生物发布首份环境、社会和管治(ESG)报告
2024年3月19日
CARVYKTI®获得美国FDA肿瘤药物咨询委员会用于复发或难治性多发性骨�..
2024年3月16日
传奇生物公布2023年全年及第四季度业绩及近期亮点
2024年3月11日
传奇生物获得CHMP对CARVYKTI®用于前线治疗的积极意见
2024年2月23日
