2023年3月31日
当地时间2023年3月18日,传奇生物(NASDAQ: LEGN)在美国新泽西州萨默塞特公布了2022全年第四季度未审计的财务业绩。
“2022年是传奇生物具有重要里程碑意义的一年,以CARVYKTI®在美国、欧洲和日本获得监管批准为标志。除了推出我们的第一个商业产品外,我们还推进了cilta-cel的临床开发计划,并获得了FDA对其两种针对实体瘤的研究性新药申请的批准。此外至关重要的是,我们扩大了我们的商业基础设施和制造能力,以支持未来的增长”。传奇生物首席执行官黄颖补充道:“我们整个公司的团队在忙碌的一年中表现出色。展望未来,我们将继续专注于扩大制造规模和推进临床计划,以将CARVYKTI®提供给更多有资格的患者。”
2022年下半年亮点及近期活动
截至2022年12月31日止年度的财务业绩
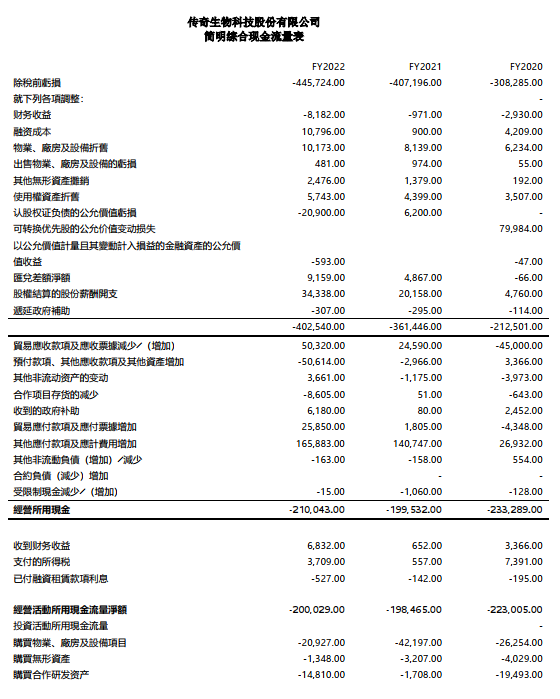
现金和现金等价物、定期存款和短期投资
截至2022年12月31日,传奇生物拥有约10亿美元现金及现金等价物、定期存款和短期投资。
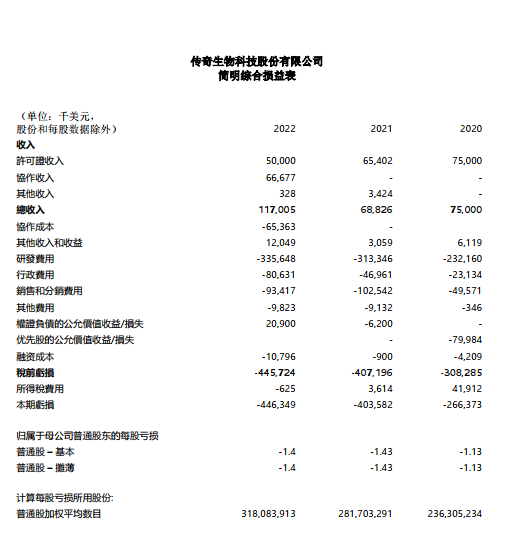
收入
截至2022年12月31日止年度的收入为1.17亿美元,而截至2021年12月31日止年度的收入为6,880万美元。增加4,820万美元是由于CARVYKTI ®在美国商业化上市的产品销售,及传奇生物的与Janssen Biotech, Inc.的合作协议(“Janssen 协议”)。
研发费用
截至2022年12月31日止年度的研发费用为3.356亿美元,而截至2021年12月31日止年度的研发费用为3.133亿美元。增加2,230万美元的主要原因是继续投资cilta-cel用于早期疗法,并增加在传奇生物的支出。传奇提交了两项研究性新药申请,并在截至2022年12月31日止年度开始为在美国进行的第一阶段临床开发做准备。
行政费用
截至2022年12月31日止年度的行政费用为8,060万美元,而截至2021年12月31日止年度的管理费用为4,700万美元。增加3,370万美元主要是由于某些信息技术服务在从金斯瑞生物科技股份有限公司分离的最后阶段,需要加强网络安全和隐私,以及支持制造设施所需的信息技术基础设施建设。
销售和分销费用
截至2022年12月31日止年度的销售和分销费用为9,340万美元,而截至2021年12月31日止年度的销售和分销费用为1.025亿美元。增加910万美元的主要原因是与CARVYKTI®商业化相关的成本。
其他收入和收益
截至2022年12月31日止年度的其他收入和收益为1200万美元,而截至2021年12月31日止年度为310万美元。增加890万美元主要是由于利息收入、政府拨款和金融资产的公允价值收益增加。
其他费用
截至2022年12月31日止年度的其他费用为980万美元,而截至2021年12月31日止年度的其他费用为910万美元。增加的主要原因是当年的外汇汇兑损失。
融资成本
截至2022年12月31日止年度的财务成本为1,080万美元,而截至2021年12月31日止年度则为90万美元。增加的主要原因是预付资金的利息,这是杨森根据《杨森协议》提供的有息借款,由本金和该本金的适用利息构成。传奇生物选择根据杨森协议的条款,于2022年12月31日增加1.303亿美元借款。
认股权证的公允价值变动收益
截至2022年12月31日止年度,认股权证负债的公允价值收益为2,090万美元,原因是传奇生物科技于2021年5月通过私募交易向机构投资者发行的初始公允价值为81.7美元的认股权证在发行日的公允价值变动。截至2022年12月31日,该认股权证被评估为一项金融负债,其公允价值为6,700万美元。
本期亏损
截至2022年12月31日止年度净亏损为4.463亿美元,或每股1.40美元,而截至2021年12月31日止年度,净亏损为4.036亿美元,或每股1.43美元。


关于传奇生物
传奇生物(NASDAQ:LEGN)成立于2014年,是一家集肿瘤免疫细胞疗法研发、临床、生产及商业化开发于一体的跨国生物制药公司,位列全球免疫细胞疗法领域第一方阵,全球员工总数已逾1000人。目前通过与杨森的合作,首款产品CARVYKTI®(西达基奥仑赛,Cilta-cel)已于2022年获得美国食品药品监督管理局(FDA)、日本厚生劳动省(MHLW)批准上市,并获得欧盟委员会(EC)附条件上市许可,有望解决多发性骨髓瘤治疗的世界级难题。2022年底,国家药品监督管理局已正式受理西达基奥仑赛的新药上市申请(NDA),并于2023年1月纳入优先审评程序。此外,公司还有多款在研细胞疗法,用于血液瘤、实体瘤及其它疑难疾病的治疗。
公司先后入选江苏省战略性新兴产业发展专项资金项目、“江苏省精准细胞免疫治疗工程技术研究中心”、“江苏省研究生工作站”、“江苏省隐形小巨人企业”、“南京市工程研究中心”,“南京市高端研发机构”、“南京市博士后创新实践基地”、“南京市独角兽企业”、“中国独角兽企业”,荣获“江苏省科技进步奖”、“中国生物医药产业链创新风云榜鲲鹏奖”、“中国医药创新企业100强”、“南京市引才用才示范企业金梧桐奖”、“《麻省科技评论》50家聪明公司”、“最具影响力创新疗法企业TOP20”、“中国医药高质量发展成果企业”等荣誉。更多信息请访问:www.legendbiotech.cn
欧盟委员会批准 CARVYKTI®用于复发和难治性多发性骨髓瘤患者的二线�..
2024年4月23日
传奇生物CARVYKTI®成为首个且唯一获FDA批准用于多发性骨髓瘤二线治�..
2024年4月5日
传奇生物发布首份环境、社会和管治(ESG)报告
2024年3月19日
CARVYKTI®获得美国FDA肿瘤药物咨询委员会用于复发或难治性多发性骨�..
2024年3月16日
传奇生物公布2023年全年及第四季度业绩及近期亮点
2024年3月11日
传奇生物获得CHMP对CARVYKTI®用于前线治疗的积极意见
2024年2月23日
